21/07/2022
Wstęp
W pięciu kolejnych tekstach poświęconych Badaniom Laboratoryjnym w Alergologii zwracamy uwagę na kilka istotnych aspektów laboratoryjnej diagnostyki alergologicznej in vitro, kładąc duży nacisk na diagnostykę molekularną. Diagnostyka molekularna, wpływająca na zmianę pozycji diagnostyki laboratoryjnej w algorytmach diagnostycznych alergii i wzrost jej znaczenia dla profilaktyki, prognozowania i strategii leczenia, stanowi w portfolio sieci DIAGNOSTYKA pozycję coraz poważniejszą, czyniąc z niej lidera na polskim rynku. Jako motto działań tym polu posłużył nam tytuł rozdziału z podręcznika Molecular Allergology. User’s guide (EAACI. 2016), brzmiący: ALERGOLOGIA OD EKSTRAKTÓW DO CZĄSTECZEK: MARIAŻ TRADYCJI I INNOWACYJNOŚCI (Allergology from extracts to molecules: integrating tradition with innovation).
Nasza oferta opiera się na pomiarze we krwi pacjenta stężenia alergenowo-swoistej IgE (sIgE). Jej obecność wskazuje na uczulający alergen, a współistnienie z objawami klinicznymi po ekspozycji na alergen, stanowi przesłankę dla rozpoznania alergii z prawdopodobieństwem proporcjonalnym do stężenie sIgE. Zgodnie z klasycznym kanonem diagnostycznym, uznanie alergii za potwierdzoną wymaga dodatniego wyniku testu ekspozycyjnego na alergen wytypowany przez identyfikację sIgE (in vitro lub in vivo). Możliwość identyfikacji sIgE in vitro dla molekularnych (cząsteczkowych) komponentów alergenowych o ściśle zdefiniowanych właściwościach biochemicznych i fizycznych oraz zdefiniowanym fenotypie reakcji alergicznej powoduje, że wykonywanie testu ekspozycyjnego (prowokacji) coraz częściej okazuje się zbędne.
Alergia – dane epidemiczne
Szacunki globalnej prewalencji chorób alergicznych są zróżnicowane ze względu na niejednorodność kryteriów metaanaliz i koncentrację większości analiz na dorosłych, podczas gdy prewalencja chorób alergicznych u dzieci jest na ogół wyższa. Bliższy rzeczywistości obraz uzyskiwać można jedynie przez zestawianie danych z różnych opracowań wykonanych w analogicznym okresie i regionie. Najogólniej, u dorosłych, globalna prewalencja chorób alergicznych, przy uwzględnieniu: astmy, alergicznego nieżytu nosa, atopowego zapalenia skóry i alergii pokarmowej waha od 1% do 20%. Częstość alergii pokarmowej zgłaszanej przez dorosłych waha się pomiędzy 2% i nawet 37%. Częstość alergicznego nieżytu nosa w skali globalnej wzrasta, dotykając 10–30% dorosłych i 40% dzieci (Allergic rhinitis. Medscape, February, 2020). Według ISAAC (ang. The International Study of Asthma and Allergies in Childhood) prewalencja globalna zgłaszanej w wywiadzie alergii na pyłki roślin u dzieci 13-14 letnich osiągnęła 22,1%. Źródła posługujące się liczbami bezwzględnymi podają, że 300 milionów ludzi na całym świecie cierpi na astmę, 200 do 250 milionów na alergie pokarmowe, a 400 milionów na nieżyt nosa.
W Europie alergia jest uważana za najczęstszą chorobę przewlekłą, która dotyczy ponad 150 milionów osób. Według obecnych prognoz do 2025 r. choroba dotknie połowy europejskiej populacji (ponad 350 milionów). W zależności od regionu i płci objawy alergii deklaruje do 40% Europejczyków (ang. self-reported allergy) i co istotne, u podobnego odsetka uzyskano dodatnie wyniki testów diagnostycznych na powszechnie występujące alergeny, co stanowi przesłankę o alergii prawdopodobnej (ang. probable allergy) w przypadku obecności sIgE lub o alergii potwierdzonej (ang. confirmed allergy) w przypadku obecności sIgE i dodatniej prowokacji.
Według EAACI z 2016 r. nawet 20% chorych na alergię zmaga się codziennie z obawą przed prawdopodobnym atakiem astmy, wstrząsem anafilaktycznym, a nawet możliwością śmierci w wyniku reakcji alergicznej. Metaanaliza publikacji (lata 2000-2012) poświęconych alergii pokarmowej, FA (ang. food allergy) w populacji Europejskiej wykazała, że zgłaszana w wywiadzie prewalencja życiowa przekraczała wg niektórych źródeł 40 % (5,7% do 41,8%), a prewalencja punktowa wśród dzieci 6-10 letnich przekraczała niekiedy 24% (1,6% do 24,4%). Prewalencja punktowa uczulenia na żywność, FS (ang. food sensitisation), z wykazaną obecnością specyficznych IgE, dochodziła w tej grupie do 52% (4,1% do 52,0). Opublikowane w 2020 r. ośmioośrodkowe badanie prewalencji alergii pokarmowej wśród dzieci 7-10 letnich w Europie (Polskę reprezentował ośrodek Łódzki), wykazało, że prewalencja zgłaszanej alergii pokarmowej wahała się, w zależności od ośrodka, od 6,5% do 24,6% (w Łodzi!); prewalencja uczulenia na żywność, FS, wahała się od 11,0% (w Reykjaviku) do 28,7% (w Zurychu), a prewalencja prawdopodobnej alergii, FA (objawy i FS z pominięciem prowokacji) od 1,9% do 5,6% (w Łodzi).
Pojęcia na temat częstości alergii w Polsce dostarczają wyniki programu ECAP (Epidemiologia Chorób Alergicznych w Polsce), opartego głównie na deklaracjach uczestników, a popartych badaniami lekarskimi w 25% przypadków. Objawy alergii deklaruje miejscami do 40% uczestników, a procent jest większy w miastach; odsetek ten pokrywa się z odsetkiem osób uczulonych, określonym testami w kierunku IgE swoistej dla najsilniej uczulających alergenów. Nieżyt nosa występował u około 22—25% osób, astma u 9—11%, pokrzywka u 5—8%, atopowe zapalenie skóry u 4—9%, a alergia pokarmowa u 5—13%.
Na pogorszenie globalnej sytuacji w dziedzinie chorób alergicznych mają wpływ zmiany klimatyczne (World Allergy Week, 2016), a szacunki oparte na raportach instytucji medycznych, historii choroby, wynikach pomiarów swoistych IgE (sIgE) dostarczają przekonujących przesłanek, że częstość alergii pokarmowej rośnie zarówno w krajach zachodnich, jak i krajach rozwijających się.
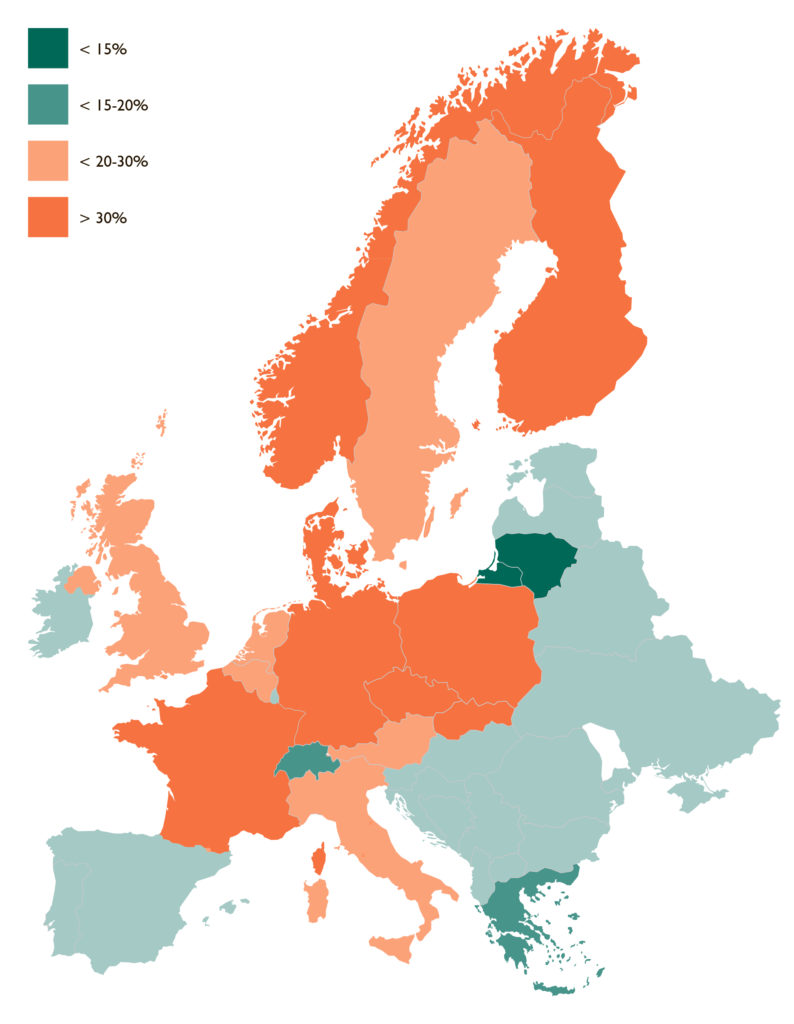
Prewalencja chorób alergicznych w Europie (Wg EFA Book on Respiratory Allergies Raise Awareness, Relieve the Burden, Ed by Erkka Valovirta, 2012).
Oferta alergologiczna DIAGNOSTYKA
Na ofertę DIAGNOSTYKI w dziedzinie pomiarów sIgE składają się testy przydatne we wszystkich strategiach laboratoryjnej diagnostyki chorób alergicznych, z coraz większym naciskiem na diagnostykę molekularną, która, jak wspominano w tym opracowaniu wielokrotnie, odkrywa przed alergologią możliwości niewyobrażalne choćby 20 lat temu, detronizując dominujące do niedawna ambulatoryjne testy skórne.
Równolegle z testami wykorzystującymi alergeny molekularne, proponujemy testy oparte na klasycznych alergenach diagnostycznych, będących typowymi ekstraktami źródła alergenu. Diagnostyka molekularna alergii niesie nowe możliwości interpretacyjne. Łączne stosowanie testów molekularnych i diagnostycznych testów poprzedniej generacji te możliwości jeszcze pogłębia. Oba rodzaje preparatów alergenowych wykorzystywane są do identyfikacji w próbce krwi IgE swoistych dla pojedynczego alergenu (testy typu singleplex, monoplex) lub do jednoczesnej identyfikacji sIgE dla zestawów (paneli) alergenów (testy typu multiplex). Testy posiadają format mikropłytek, blotu (uproszczona forma Western blotu), mikromacierzy lub nanomacierzy i wykorzystują zasadę testów immunochemicznych fazy stałej. Identyfikowana IgE wyłapywana jest z próbki przez alergeny związane z podłożem (alergeny wyłapujące) – nośnikiem, którym może być pasek bibuły, kulka lub mikrokulka (ang. microbead) z tworzywa sztucznego o różnej średnicy, ścianka studzienek mikropłytki etc. W przypadku unikalnego rozwiązania zastosowanego w immunochemicznym analizatorze Immulite 2000 (system 3gAllergy™), alergeny diagnostyczne dodawane są do próbki w postaci ciekłej i wiążą sIgE w roztworze, a powstały kompleks wyłapywany jest przeciwciała anty-IgE związane z fazą stałą. Kinetyka wiązania jest w tej sytuacji zbliżona do warunków naturalnych zapewniając parametry analityczne testu trudne do osiągnięcia innymi metodami. Liczba alergenów w panelach waha się od kilku do ok. 300, choć najczęściej wynosi 10 lub 20. Panele komponowane są zgodnie z podziałem na wziewne (oddechowe) lub pokarmowe; na podstawie doboru „tematycznego” (np. pyłki roślin); pod kątem wieku pacjenta (np. panel pediatryczny) lub pod kątem prewalencji uczulania (mieszany panel atopowy).
Duża liczba elementów w zestawach alergenów molekularnych wynika z konieczności uwzględniania kilku składników molekularnych danego źródła alergenu (przykładowo po 6 dla orzecha arachidowego i pyłku tymotki w teście 300 składnikowym panelu Alex). Uwzględnianie możliwie dużej liczby alergenów molekularnych z danego źródła pozwala na uzyskanie większej ilości informacji o znaczeniu diagnostycznym, klinicznym, prognostycznym etc.
Duża liczba elementów w panelach jest istotna dla diagnostyki przesiewowej, szczególnie w przypadku trudności z uzyskaniem wyczerpującego wywiadu czy braku szczegółowej historii choroby. Pomiary sIgE dla alergenów pojedynczych są wykonywane najczęściej dla potwierdzania diagnozy postawionej w wyniku wywiadu i ustalonych objawów klinicznych.
Algorytm diagnostyczny w oparciu o testy oferty Diagnostyki
Algorytm rozpoznawania i różnicowania chorób o podłożu alergicznym pozostaje całkowicie w zakresie uznania i decyzji lekarza. Przedstawiona na rysunku poniżej sekwencja postępowania diagnostycznego opartego na pomiarach sIgE in vitro, zgodna z klasycznym algorytmem Top down, ma jedynie przedstawić w działaniu różnorodność oferty DIAGNOSTYKI. Portfolio testów identyfikujących ilościowo sIgE in vitro pozwala na wybór panelu alergenów o składzie najbardziej zbliżonym do profilu prawdopodobnych przyczyn alergii u pacjenta, wytypowanego na podstawie historii choroby, objawów klinicznych, ich nasilenia, sezonowości etc. I tak w pierwszym etapie hipotetycznego algorytmu pomocą immunoblotu o granicy wykrywalności 0,35 kU/l wykazano obecności sIgE dla alergenów jabłka (F49) i pyłku brzozy (T3). Następnie powtórzono pojedyncze pomiary dla F49, T3, dodatkowo rozszerzając diagnostykę o ekstrakty pyłku innych drzew pylących w podobnym okresie, stosując system 3gAllergy™, Siemens o trzy razy niższej granicy wykrywalności: 0,1 kU/l. Po potwierdzeniu obecności sIgE wyłącznie dla F49 i T3, w oparciu o alergeny wybrane alergeny molekularne, rozpoznano u badanego zespół alergii jamy ustnej (OAS): zespół brzoza-jabłko powodowany przez homologi: Bet v 1 brzozy i Mel d 1 jabłka.
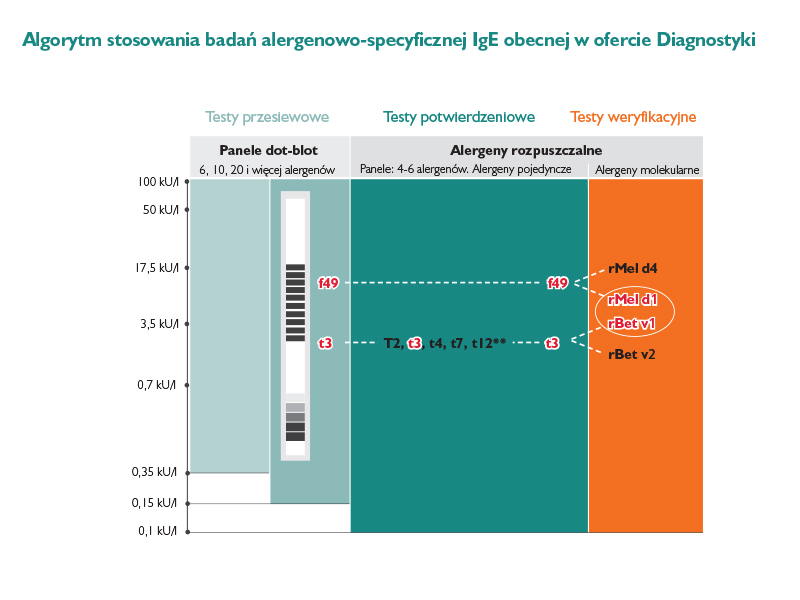
Przykładowy wariant procedury diagnostycznej ilustrujący sposób wykorzystania testów różnych generacji obecnych w portfolio DIAGNOSTYKI, zgodny z klasycznym algorytmem diagnostycznym Bottom up.
Dr Tomasz Ochałek,
Laboratoria Medyczne DIAGNOSTYKA
Wybrane pozycje piśmiennictwa
- Clausen M. at al: Prevalence of Food Sensitization and Food Allergy in Children Across Europe. J Allergy Clin Immunol Pract. 8, 2736-46, 2020.
- Wise, S.K.et al.: International Consensus Statement on Allergy and Rhinology: Allergic Rhinitis.International Forum of Allergy & Rhinology: 8, 2018; First published: 13 February 2018, https://doi.org/10.1002/alr.22073
- Dierick B. J.H. et al.: Burden and socioeconomics of asthma, allergic rhinitis, atopic dermatitis and food allergy. Expert Review of Pharmacoeconomics & Outcomes Research 20, 2020, 437-453, published online: 14 Sep 2020
- Pawankar R.: Allergic diseases and asthma: a global public health concern and a call to action. World Allergy Organ J. 7,12,2014 . Published online 2014 May 19. doi: 10.1186/1939-4551-7-12.
Zachęcamy do przeczytania pozostałych artykułów o Alergiach, przygotowanych przez naszych specjalistów:
ALERGIA II – Strategie diagnostyczne chorób alergicznych
ALERGIA III -Diagnostyka molekularna alergii
ALERGIA IV – Implikacje kliniczne i diagnostyczne pomiarów sIgE
